服务热线
解析马来西亚医疗器械监管体系下的 CAB
定义:CAB 是由马来西亚医疗器械管理局(MDA)注册的独立组织,负责评估、审核和验证医疗器械和机构是否符合《2012 年医疗器械法》(第 737 号法案)及其相关法规中概述的适用监管要求.
主要职责
符合性评估
评估医疗器械的技术文件、设计、制造工艺及性能特征,确保其符合相关标准与法规。
审核与评估
对医疗器械制造商、授权代表、进口商及分销商进行审核与评估,验证其是否遵循质量管理体系,如 ISO 13485 及医疗器械良好分销规范等。
测试与评价
医疗器械开展测试与分析,评估其安全性、性能及有效性。
认证与发证
于成功的评估,颁发合格评定证书,表明医疗器械符合规定的标准与法规。
资质认定条件
组织要求
申请成为 CAB 的组织,其结构与组成需符合相关规定,包括具备完善的管理体系、专业的技术人员等.
人员要求
AB 的管理人员和操作人员须为马来西亚公民.
技术能力与资源
拥有足够的技术资源和专业能力,以确保能够准确、有效地开展评估工作,包括具备相应的测试设备、实验室设施等.
质量管理体系
建立并运行符合要求的质量管理体系,以保证评估过程的公正性、科学性和可靠性.
CAB在认证流程中的作用
技术审查
制造商或其当地授权代表将技术文件提交给 MDA 指定的 CAB,CAB 会对文件及质量管理体系等进行详细评估,只有通过审查,产品才有可能获得 CAB 证书.
分类评估
根据医疗器械的风险等级,CAB 会采取不同的评估方式。对于有参考国家批准的医疗器械进行验证,而无参考批准的则需进行全面评估.
市场监管
AB 还会参与医疗器械的上市后监管活动,通过定期审计、评估和测试,确保已上市产品持续符合法规和标准要求.
CAB参与的环节
产品注册阶段-Conformity Assessment
Class B/C/D类首次注册,重大变更申请,续证申请
体系认证阶段- Audits and Assessments
制造商(当地体系认证or境外企业现场审核)、授权代表、进口商和分销商
不需要CAB审核的情况
Class A类注册,2类及3类发生变更时的通知申请-只需要提交给药监局MDA
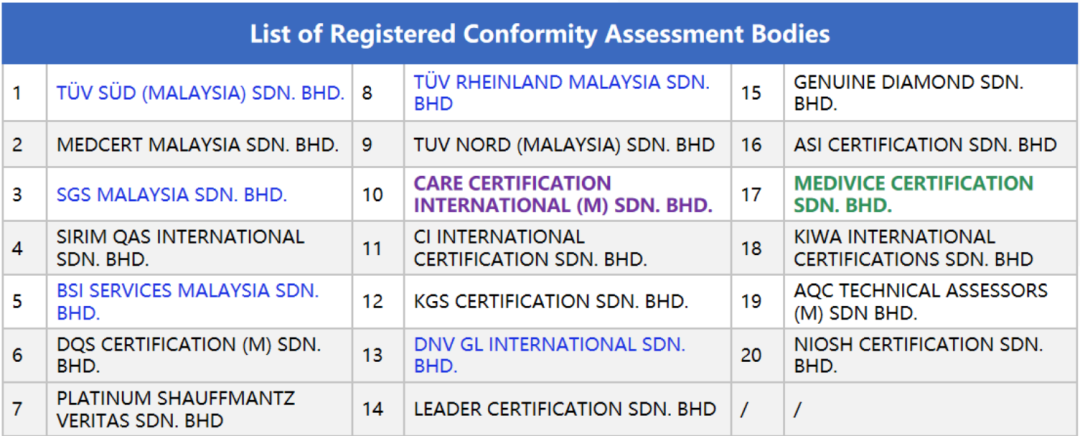
CAB清单
1、TÜV SÜD (MALAYSIA) SDN. BHD.
2、MEDCERT MALAYSIA SDN. BHD
3、SGS MALAYSIA SDN. BHD.
4、SIRIM QAS INTERNATIONAL SDN. BHD.
5、BSI SERVICES MALAYSIA SDN.BHD.
6、DQS CERTIFICATION (M) SDN.BHD.
7、PLATINUM SHAUFFMANTZ VERITAS SDN. BHD
8、TÜV RHEINLAND MALAYSIA SDN.BHD
9、TÜV NORD (MALAYSIA) SDN. BHD
10、CARE CERTIFICATION INTERNATIONAL(M) SDN. BHD.
11、CI INTERNATIONAL CERTIFICATION SDN. BHD.
12、KGS CERTIFICATION SDN. BHD
13、DNV GL INTERNATIONAL SDN. BHD.
14、LEADER CERTIFICATION SDN. BHD.
15、GENUINE DIAMOND SDN.BHD.
16、ASI CERTIFICATION SDN. BHD.
17、MEDIVICE CERTIFICATION SDN. BHD.
18、KIWA INTERNATIONAL CERTIFICATIONS SDN. BHD.
19、AQC TECHNICAL ASSESSORS(M) SDN. BHD.
20、NIOSH CERTIFICATION SDN.BHD.