服务热线
马来西亚医械综合概况、注册流程及常见问题
马来西亚人口约3346万(2024),首都吉隆坡。共分为 “13 个州 + 3 个联邦直辖区”。联邦直辖区是由中央政府直接管辖的地区,而州则有一定的地方自治权。其中,有 9 个州拥有自己的王室,这些王室在当地的传统事务和部分礼仪性事务等可能发挥一定的作用。
种族划分:
马来人和土著(Bumiputera):占人口比例超过 70%。“Bumiputera” 在马来西亚语境中有 “土地之子” 的含义,包括马来人以及其他一些被认定为原住民的群体。他们在这个国家的人口构成中占主导地位。
华人:占约 23%。马来西亚华人有着自己独特的文化和经济活动,在马来西亚的经济、文化等诸多领域都有重要贡献。
印度人:约占 6.6%。他们也为马来西亚的多元文化和经济发展发挥作用。
其他:占 0.8%,包括其他一些种族群
宗教信仰:
马来西亚大多数人信仰伊斯兰教中的逊尼派。宗教在这个国家的社会、文化和生活等诸多方面可能会产生深远的影响。
市场规模与增长:
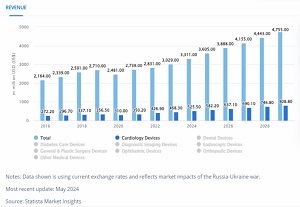
马来西亚医疗器械市场规模增长迅速,2022 年市场规模超 30 亿美元,年复合增长率超 16%,人均医疗器械费用支出约 68-70 美元,预计 2023 年市场规模将超 40 亿美元。2024年,马来西亚医疗器械市场预计收入33.11亿美元。2024-2029年,预计将保持7.51%的稳定年增长率(复合年增长率),到2029年市场规模将达到47.55亿美元。
进出口情况:
马来西亚制造的医疗器材 90% 以上出口至世界各地,是全球导管、外科和检查手套等橡胶类医疗器械的主要生产和出口国,供应全球 80% 的导管和 60% 的橡胶手套。而在进口方面,美国医疗器械产品占马来西亚医疗器械进口市场份额的 21%,其次为新加坡、德国、日本、中国和韩国等。
市场需求与驱动因素:
由于医疗保健投资的增加和人口老龄化的加剧,马来西亚的医疗设备市场正在经历快速增长。马来西亚对医疗器械的需求不断增加,特别是在医用影像设备、心血管器械、外科手术器械、诊断试剂、呼吸器等领域,市场需求呈现快速增长的态势。此外,政府对医疗卫生事业的重视和投入,以及不断完善的医疗保健体系,也为医疗器械市场的发展提供了有力支撑。2024年,心脏病设备预计是最大的,预计市场规模为5.255亿美元。
法规与监管:
所有在马来西亚生产、进口的医疗器械产品都必须在医疗器械管理局进行注册后方可进入市场,且产品需符合国际认证标准,如 iso13485 和 ce 认证等,这在保障市场秩序和产品质量安全的同时,也提高了市场的准入门槛。
马来西亚的医疗机构呈现出多元化的格局。2024 年卫生部医疗预算达到 RM 412.2 亿(约 87.6 亿 USD)。其中医院方面有148 家,提供 45167 个床位,包括 5 家部队医院(612 个床位)和 7 家大学医院(4206 个床位)。这些医院有公立和私立之分,公立医院是政府运营,为民众提供基本医疗服务;私立医院以先进设备、优质服务和舒适环境吸引患者,部分还获得国际认证,推动医疗旅游发展。医疗诊所有 3 万多家,有卫生诊所、农村诊所、妇幼保健诊所和社区诊所等。牙科诊所有 1700 多家,包括独立、学校和移动牙科诊所等不同类型。
确定是否为医疗器械
依据马来西亚医疗器械法规,综合产品预期用途、使用方式、侵入程度等因素,确定产品是否属于医疗器械
确认分类和分组
对照 MDA 分类标准,将其归入 A、B、C、D 四类及相应分组。例如,普通体温计多为 A 类,而心脏支架则属 D 类。
选择注册代理(如适用)
境外制造商需挑选在马来西亚具备医疗器械经营资质与良好分销规范认证的合法实体作为注册代理。双方签订协议明确协助注册、沟通联络等职责。
CAB机构审核(B,C,D类)
B、C、D 类医疗器械需由马来西亚认可的 CAB 机构审核。CAB 依据 MDA 法规与相关标准评估产品技术文件,涵盖设计制造、质量控制、临床评估(如适用)等方面内容。审核完毕出具报告,通过则助力后续 MDA 审核,未通过则需制造商整改后重新提交。
在线提交注册申请
通过 MDA 官方在线系统提交申请,填报产品详情(名称、型号、用途等)、制造商信息及代理信息(若有),并上传产品技术文件、CAB 审核报告(B、C、D 类)、质量管理体系文件等支持文件,提交前确保信息完整准确。
支付申请费
依据医疗器械类别与申请类型确定申请费金额,MDA 提供银行转账、在线支付等多种缴费途径,缴费成功后留存凭证。
MDA审核
MDA 收到申请费后启动审核,先进行形式审查,再展开技术与法规审查,过程中可能要求补充材料或解释问题,申请人需及时回应以推进审核。
支付注册费(B,C,D类)
若 MDA 审核通过,B、C、D 类产品需按通知要求支付注册费,费用高于申请费,同样按规定方式完成缴费。
签发电子注册证
在确认注册费支付后,MDA 为合格产品签发电子注册证,企业需妥善保管并依规使用,注册证有效期内产品可在马来西亚市场合法销售,临近有效期需申请续期。
同一个产品,能否多个申请?
同一个产品可以有多个注册申请,但每个申请都需要单独的注册证。如果一个产品在不同的类别或不同的适用市场上有不同的注册要求,可以考虑为不同市场或用途分别申请注册证。
注册证持有人是制造商吗?能否更换注册持有人?
注册证持有人不一定是制造商,持有人可以是当地的授权代理商或分销商。注册证持有人可以更换,但需要遵循马来西亚医疗器械局(MDA)的相关要求,重新提交相应的文档和申请。
有ISO13485证书是否就不来审厂?
持有ISO 13485证书并不意味着免审。马来西亚医疗器械局(MDA)会对医疗器械制造商进行工厂审核,尤其是对于高风险类别的设备。ISO 13485认证虽然有助于简化一些审核过程,但并不完全免除审厂要求。
产品和组件能否作为一个申请提交?
产品和组件是否可以作为一个申请提交要看具体情况。如果组件是产品正常运行不可或缺的一部分,并且在产品的安全性和有效性评估中需要整体考虑,那么可以作为一个申请提交。但如果组件是可选的或者单独销售且有独立的功能和用途,可能需要分别进行申请。
当地代理商持证和第三方持证有什么区别?
当地代理商持证意味着代理商已经在马来西亚正式注册,并可以代表制造商提交注册申请和进行其他注册相关事务。第三方持证则通常指的是制造商授权非当地代理商的第三方机构来持有注册证。在责任划分上,当地代理商持证时其责任更集中于产品的整体合规管理;第三方持证时,第三方主要负责注册相关事务,代理商的职责相对更侧重于市场渠道方面,但仍需要在一定程度上配合产品的法规要求。
第三方持证的话,当地代理商能否直接进口产品?
在第三方持证的情况下,当地代理商是否能直接进口产品要看具体的授权安排和马来西亚医疗器械法规的要求。如果第三方持证者授权代理商进行进口操作,并且代理商满足进口相关的法规要求(如具备进口资质、符合海关和卫生检疫等要求),那么代理商可以进口产品。但如果没有这样的授权或者代理商不符合进口的其他条件,就不能直接进口产品

