服务热线
印度尼西亚医疗器械及体外诊断产品的分类指南(三)
在医疗领域中,体外诊断(IVD)产品在疾病诊断、治疗及预防等环节发挥着关键作用。为了确保这些产品的规范管理和安全使用,印尼对体外诊断产品也有着详细的分类规则。这些规则依据产品的不同用途、检测对象、风险程度等因素,将 IVD 产品分为不同类别,每个类别都有其特定的界定和意义,本文下面将详细介绍这部分内容。
规则 1:
基于以下用途的 IVD 产品归为D类
用于针对血液、血液成分、血液衍生物、细胞、组织或器官中可传播的传染性病原体,检测其存在与否以及人体暴露情况,以评估这些物质用于输血或移植的适宜性;
用于检测可传播且会引发危及生命、通常难以治愈且高传播风险疾病的传染性病原体的存在或暴露情况的 IVD产品。
示例:
检测艾滋病毒(HIV)、丙型肝炎病毒(HCV)、乙型肝炎病毒(HBV)感染的检测,此规则适用于初次检测、确证检测及附加检测。
综合分析:
此类体外诊断(IVD)产品对确保输血所用血液及血液成分安全,以及(或)确保移植用细胞、组织和器官的安全至关重要。其检测结果具有决定性作用,关键在于决定所捐献的血液、细胞、组织、器官等是否可用。这些产品涉及的是可导致死亡或长期残疾的严重疾病,往往难以治愈或需重大治疗手段,准确诊断对于降低公共健康风险意义重大。
规则 2:
基于以下用途的 IVD产品归为C类
用于确定血型或组织类型,以确保拟用于输血或移植的血液、血液成分、细胞、组织或器官在免疫学上适配性的产品。
示例:
人类白细胞抗原(HLA - A、HLA - B、HLA - C、HLA - D)的组织分型检测。
基于以下用途的 IVD 产品归为D类
用于确定 ABO 血型系统分组 [A(ABO1)、B(ABO2)、AB(ABO3)]、恒河猴血型系统 [RH1(D)、RH2(C)、RH3(E)、RH4(c)、RH5(e)]、凯尔血型系统 [Kel1(K)]、基德血型系统 [JK1(Jka)、JK2(Jkb)] 以及达菲血型系统 [FY1(Fy)、FY2(Fyb)] 的产品。
示例:
血型检测(抗 A、抗 B、抗 A,B)。
综合分析:
这些规则应用的原理是,此类检测对个体风险很高,若结果有误,患者将处于明显危及生命的状况,因此根据检测血型抗原的性质将血型分组设备分为 C 类或 D 类。这对体外诊断产品发展和输血流程规范非常重要。
规则 3:
基于以下用途的 IVD 产品归为C类
用于检测性传播感染病原体的存在或人体暴露情况。
如:沙眼衣原体检测、淋病奈瑟菌检测。
用于检测脑脊液或血液中传播风险有限的感染病原体的存在情况。
如:脑膜炎奈瑟菌检测、新型隐球菌检测。
用于检测若结果错误会给受检个体或胎儿带来死亡或严重残疾极大风险的感染病原体的存在情况。
如:巨细胞病毒(CMV)诊断检测、肺炎衣原体检测、耐甲氧西林金黄色葡萄球菌检测。
用于产前筛查以确定对可传播感染病原体的免疫力。
如:风疹、弓形虫免疫力检测。
用于确定传染病状态或免疫状态,若存在错误结果会导致患者治疗决策失误并使患者面临生命威胁。
如:如对移植患者进行肠道病毒、巨细胞病毒和单纯疱疹病毒检测。
用于筛选、挑选需要特殊治疗的患者,或确定疾病阶段,或癌症诊断。
如:CD4 检测。
用于人类基因检测。
如:亨廷顿氏病和囊性纤维化检测。
用于监测药物、物质或生物成分水平,若存在错误结果会导致患者处理决策失误并使患者面临生命威胁。
如:心脏标志物(肌钙蛋白检测、肌酸激酶同工酶(CK - MB)检测、脑钠肽(BNP)检测)以及环孢素、凝血酶原时间检测。
用于治疗患有危及生命的传染病的患者。
如:丙型肝炎病毒(HCV)载量、人类免疫缺陷病毒(HIV)载量、HIV 亚型及基因分型以及 HCV 相关检测。
用于筛查胎儿的先天性异常。
如:脊柱裂检测、唐氏综合征检测。
综合分析:
这些体外诊断医疗工具的应用规则基于对公共健康存在中等风险或对个体存在高风险,错误检测结果会使患者处于危及生命状况或产生重大负面影响。此类工具对正确诊断至关重要。
注意:根据规则 6,用于在进一步调查之后确定选择何种治疗方案,并且该设备被用于监测治疗效果,那么该设备将被归入B类。
规则 4:
基于以下用途的 IVD 产品归为B类
并非用于医疗判定,或仅具有初步性质且需要进一步专业健康实验室检测的体外诊断产品。
示例:
自用的验孕测试、生育能力检测、尿液检测试纸。
基于以下用途的 IVD 产品归为C类
供个人使用的产品,以及由医护人员为患者进行的血液气体和血糖检测(非在专业健康实验室中进行)的产品,其他供在患者附近使用的体外诊断医疗器械按风险使用分类规则归类。
示例:
血糖监测。
综合分析:
这些工具由不具备专业技术能力的个人使用,因此清晰的标识和使用说明对获得准确测试结果非常重要。
规则 5:
基于以下用途的 IVD 产品归为A类
具有特定特性的试剂或其他材料(由制造商指定按照特定检测相关的体外诊断流程使用)、制造商专门指定用于体外诊断流程的仪器、样本容器。
示例:
选择性 / 鉴别性微生物培养基(不包括成品干粉类产品)、培养微生物的鉴定装置、清洗液、用于尿液、痰液、粪便等的仪器及容器 / 杯。
注意事项:
所有生产、销售或未用于体外诊断医疗器械的一般实验室用途产品,按定义通常不视作体外诊断医疗器械,但在一些国家可能被视为体外诊断医疗器械。
综合分析:
上述分类基于设备对个体风险较低,且对公共健康无风险或仅有极小风险。
注1、在一些国家,对上述分类的这些设备是否为体外诊断产品可能有不同看法。
注2、软件或仪器性能需要满足特定要求,那么必须进行特定的测试来验证,测试将与试剂盒一同评估时进行考量。
注3、仪器与测试方法之间存在相互依存关系,尽管设备本身被归类为 A 类,但应避免对这些仪器进行单独评估。
规则 6:
未被规则 1 - 5 涵盖的体外诊断(IVD)医疗器械归为B类
示例:
幽门螺杆菌以及激素、维生素、酶、代谢标志物、特异性 IgE 水平等生理标志物的检测。
综合分析:
此规则应用原理是,错误结果对个体构成中等风险,但不太可能导致死亡或严重残疾,对患者无重大负面影响,也不会使个体立即处于危险中。此类体外诊断的阳性结果通常只是若干决定性因素之一,若检测结果是唯一决定因素,但有其他体征、症状或临床信息可参考,该产品也归类为 B 类。在控制其他相关事宜时,这类产品可用于验证检查结果。此外,此类还包括对公共健康构成低风险的设备(所检测的传染性病原体在人群中不易传播)。
规则 7:
未明确规定定量和定性数值的体外诊断(IVD)校准物,归为B 类
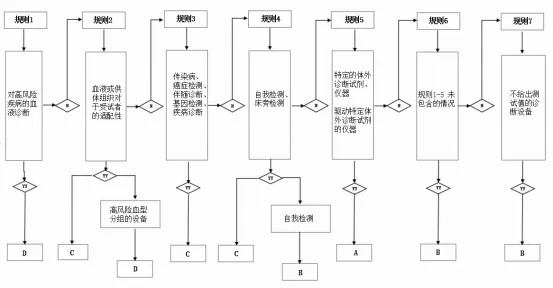
体外诊断产品的分类规则图
印尼体外诊断产品的分类规则全面且细致,这些规则从不同角度考虑了产品在实际医疗应用中的各种情况,无论是针对不同类型病原体的检测、特定医疗场景下的应用,还是从产品本身的特性和风险程度出发,都为体外诊断医疗器械的合理分类、规范管理和安全使用提供了重要依据。希望上文内容对大家有所帮助。

