服务热线


中国如何定义医疗器械?
《医疗器械监督管理条例》第八章附则中医疗器械定义是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件。
医疗器械的使用旨在达到下列预期目的:
1.对疾病的预防、诊断、治疗、监护、缓解。
2.对损伤或者残疾的诊断、治疗、监护、缓解、补偿。
3.对解剖或者生理过程的研究、替代、调节或者支持。
4.对生命的支持或者维持。
5.妊娠控制。
6.通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。
中国将医疗器械按照不同风险分为三类:
· 第一类医疗器械(低风险)如:纱布、绷带、医用退烧贴等
· 第二类医疗器械(中风险)如,输液器、手术手套、理疗仪器等
· 第三类医疗器械(高风险),如心脏支架、心脏起搏器、人工关节等
第一类医疗器械实行产品备案管理。第二类、第三类医疗器械实行产品注册管理。
· 境内第一类医疗器械备案,备案人向设区的市级负责药品监督管理的部门提交备案资料。
· 境内第二类医疗器械由省、自治区、直辖市药品监督管理部门审查,批准后发给医疗器械注册证。
· 境内第三类医疗器械由国家药品监督管理局审查,批准后发给医疗器械注册证。
· 进口第一类医疗器械备案,备案人向国家药品监督管理局提交备案资料。
进口第二类、第三类医疗器械由国家药品监督管理局审查,批准后发给医疗器械注册证。
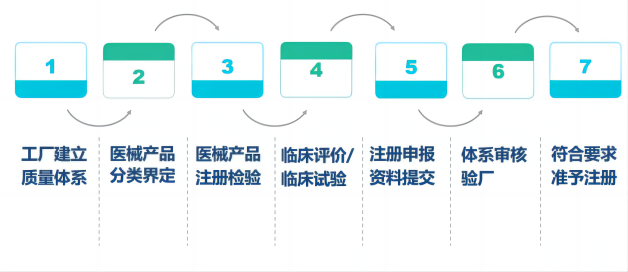
国瑞中安为医疗器械企业提供如下全流程咨询辅导注册服务:
025-83263123
国瑞中安长三角业务中心
手机:17715243573
电话:025-83263123
邮箱:weedyu@grzan.cn
地址:南京市建邺区奥体大街69号1栋507室

